01国自然热点趋势
近年来关于“铁死亡”、“铜死亡”频频登上热门,如何在细胞死亡领域突破传统死亡,创新性拿下国自然呢?
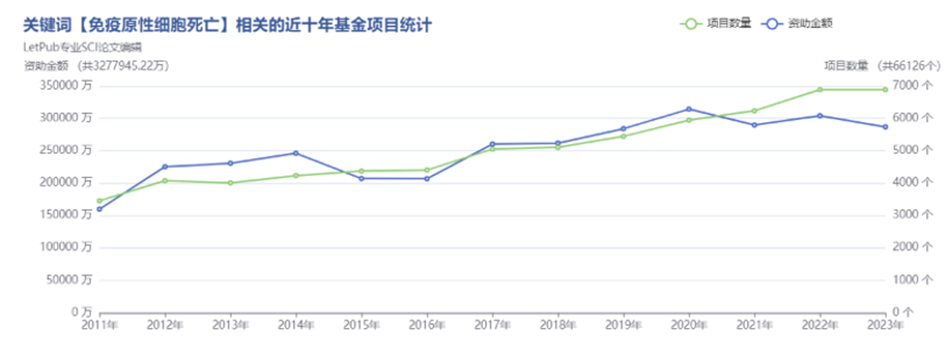
02免疫原性细胞死亡
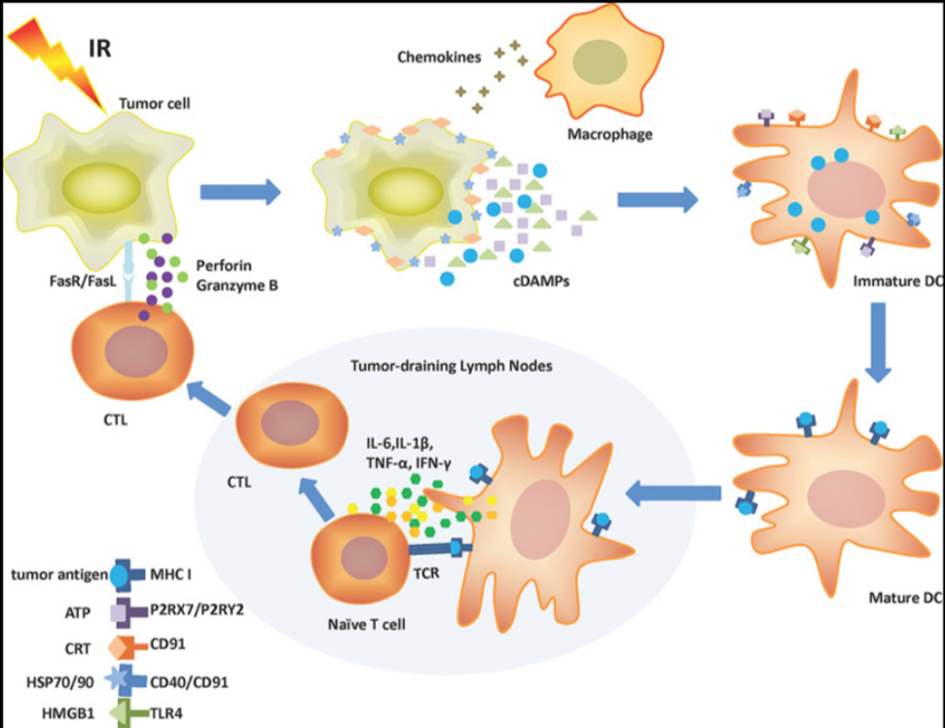
免疫原性细胞凋亡(Immunogeniccelldeath,ICD)系一种能在免疫功能完善的宿主体内激发适应性免疫响应的调控性细胞凋亡(regulatorycelldeath,RCD)模式[1]。发生ICD的癌细胞在濒死状态下表达或释放损伤相关分子模式(dangerassociatedmolecularpatterns,DAMPs),吸引抗原呈递细胞辨识、吞噬并呈递死亡细胞抗原,激发特异性T细胞反应,清除残余肿瘤细胞并建立长期免疫记忆,对于延长病患生存期具有重大价值。自2005年首次发现以来[2],当前已有诸多化疗药物、放射疗法、物理疗法、溶瘤病毒、纳米材料等抗肿瘤疗法被证实具有ICD诱发效应。
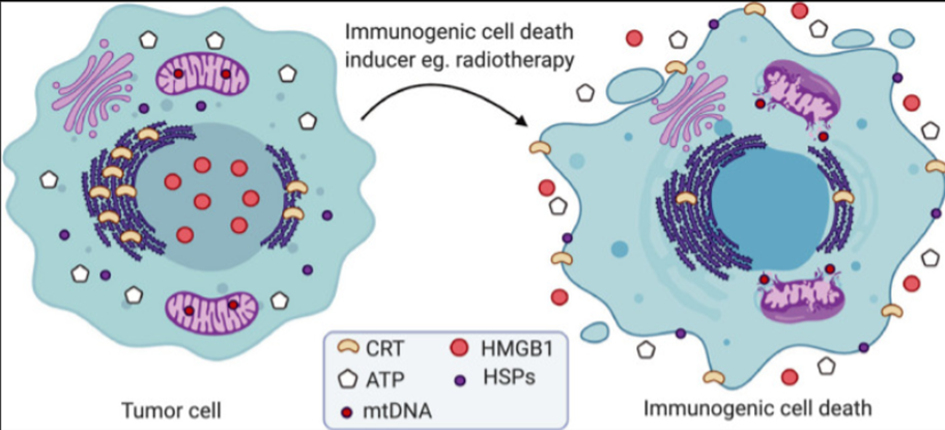
03免疫原性细胞死亡机制
ICD释放的DAMP可以激发众多免疫细胞的招募和活化,提升肿瘤相关抗原的处理和呈现,终将导致强大的抗肿瘤免疫并有可能产生长久的免疫记忆。长期以来,RCD被视为一种由基因编码的多信号通路共同调控的细胞死亡形式[3][4]。然而,研究近期发现,特定应激压力诱导的RCD能够诱发机体自身细胞释放DAMP并驱动炎症反应,最终触发CTL介导的适应性免疫应答。这种能触发适应性免疫应答的RCD模式被称之为ICD[3][5]。
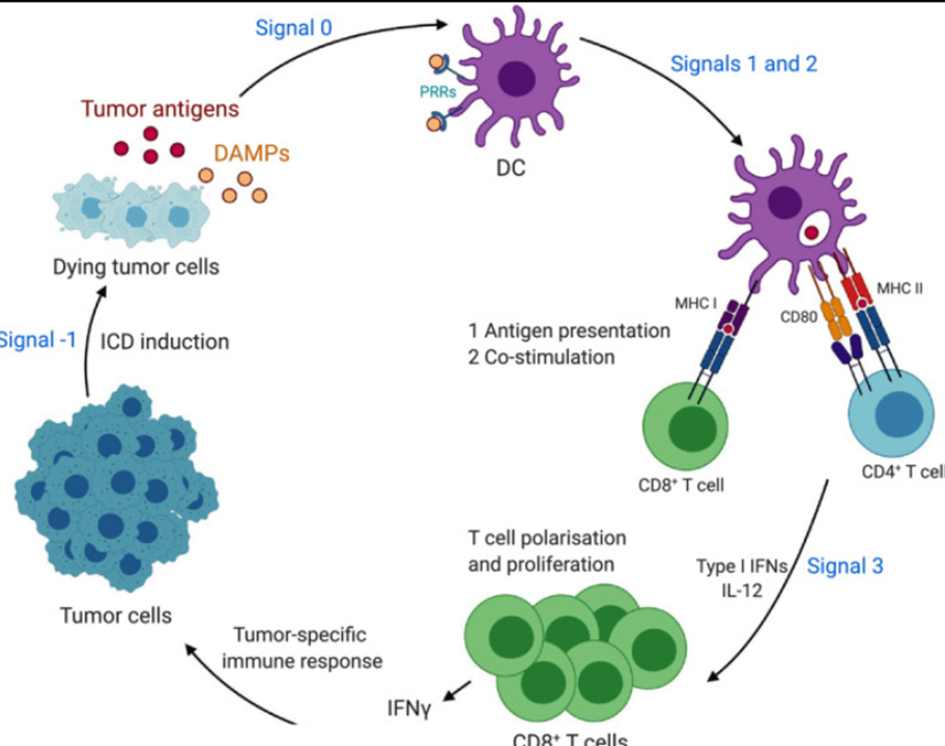
04诱导免疫原性细胞死亡
01化疗药物
5-氟尿嘧啶(5-fluorouracil,5-FU)为嘧啶类似物,主要透过抑制核苷酸合成所需的胸苷酸合酶,展现出抗结直肠癌的良好疗效。铂类药物奥沙利铂以及拓扑异构酶Ⅰ抑制剂伊立替康常常与5-FU联合运用于FOLFOX(氟尿嘧啶、亚叶酸和奥沙利铂)或FOLFIRI(氟尿嘧啶、亚叶酸和伊立替康)综合治疗方案之中,以提升化疗效果[6]。研究表明,在小鼠结肠癌细胞系CT-26以及人类癌细胞中,5-FU或伊立替康所引发的ICD特征分别表现为细胞增殖调整和MHC-1的表达[7]。相比之下,奥沙利铂(而非顺铂)触发内质网应激和CRT暴露行为,在结直肠肿瘤同基因小鼠模型中,能够有效地引发ICD[8]。进一步发现,金丝桃素联合光动力疗法已被证实可诱导phox-ER应激,从而促使早期诱发 ecto-CRT表达,以及ATP的主动分泌和热休克蛋白(heatshockprotein,HSP)的被动释放,如 HSP70 和 HSP90等,在细胞凋亡的晚期阶段,该方案还可以通过在未免疫小鼠中诱导ICD,有效抑制肿瘤增长[9]。
02纳米药物
Kuai等人[10]发现,相较于使用游离多柔比星进行治疗,将多柔比星加载至合成的高密度脂蛋白(Sythetichighdensitylipoprotein,sHDL)样纳米盘内,纳米给药系统在肿瘤中的药物有效浓度显著提升,CD8+淋巴细胞相较于对照组增长了三倍。此种治疗策略在盲肠部的MC38结肠细胞疾病中疗效显著,成功率高达80%.Alizadeh等人[11]研发出一种封装姜黄素的聚合物纳米载体(Polymericnanocarrier-curcumin,PNCC),显著提升了对结直肠癌(colorectalcancer, CRC)的化学预防效果。他们通过对肿瘤数量、大小和位置进行表征,对比游离姜黄素与PNCC对偶氮甲烷(azomethanem, AOM)诱发的结肠癌的预防作用。研究结果显示,与游离姜黄素治疗组相比,PNCC治疗组动物的肿瘤体积和数量明显减少。并且,PNCC在抑制β-连环蛋白的激活(已知的致癌机制)以及刺激Bcl-2基因相关X蛋白的生成方面表现出色,展示出更高的抗肿瘤特性。
03氧增强光动力疗法
研究揭示,氧增强光动力疗法通过调控光敏剂以及活性氧,引发phox-ER应激反应,进而诱发抗癌免疫以抵御癌细胞。这一治疗策略能够高效且选择性地消弭残留或转移性肿瘤[12]。在实体瘤环境中,缺氧条件有助于肿瘤扩散,而这种缺氧状态是降低PDT疗效的一大障碍[13]。针对缺氧对PDT疗效的制约,Chen等人[14]利用蛋白杂交技术,成功将生物杂化蛋白氧纳米载体装载上Ce6(氯代乙酰己氧基铕6,简称C@HPOC)。借助光敏剂和活性氧的肿瘤定向联合输送,C@HPOC显著提升了肿瘤组织的氧浓度。得益于此,C@HPOC显著优化了PDT的抗肿瘤效能,进一步证实了PDT的显著疗效[14]。
05高分文章
近年来多篇有关免疫原性细胞死亡的文章频繁登上了一区文章,那我们又该如何聚焦呢?
下面这篇发表在Mol Oncol.(IF 6.6./ Q1)上的综述讨论了与ICD相关的细胞死亡方式,ICD期间暴露的DAMP以及它们激活免疫系统的机制。最后,文章讨论了在癌症免疫治疗中利用ICD的治疗潜力和挑战。

这篇发表在Nat Immunol.(IF 30.5/Q1)的研究表明免疫原性细胞死亡(ICD)在免疫监视中起着关键作用,病原体和癌细胞都进化了防止将细胞死亡识别为免疫原性的策略。有趣的是,正常细胞屈服于促进翻译后新抗原形成的条件(例如氧化应激)也可以驱动至少一定程度的抗原特异性免疫,这表明ICD在与自身反应性相关的非感染性、非恶性疾病的病因学中具有新的意义。

而利用NDDSs,通过化疗、PDT、PTT和放疗联合免疫疗法加载多种药物诱导ICD,可以促进治疗效果并减少与癌症治疗相关的副作用。

06免疫原性细胞死亡相关的初步思路与课题
随着铜死亡、铁死亡等创新点的大火,让我们更加深入探究细胞死亡的特殊性。目前,免疫原性细胞死亡在国自然立项的项目并不是很多,免疫原性细胞死亡可以结合靶向药物、代谢、炎症等进行结合。
下面是一些研究思路:
1. 基础研究方面:可通过深入研究免疫原性细胞死亡如何的具体机制;也可深入探索免疫原性细胞死亡与疾病之间的关系;或可从时空角度探索免疫原性细胞死亡的发生发展;
2. 转化研究:研究免疫原性细胞死亡开发新型药物;或利用新技术如人工智能等挖掘更多免疫原性细胞死亡的潜在靶点。
参考文献
[1] GALLUZZI L,VITALE I,AARONSON S A,et al. Molecular mechanisms of cell death:Recommendations of the Nomenclature Committee on Cell Death 2018[J]. Cell Death Differ, 2018, 25 (3):486-541.
[2] CASARES N,PEQUIGNOT M O,TESNIERE A,et al. Caspasedependent immunogenicity of doxorubicin- induced tumor cell death[J]. J Exp Med,2005,202(12):1691-1701.
[3] GalluzziL, VitaleI, Aaronson SA, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committeeon Cell Death 2018 [J]. Cell Death Differ, 2018, 25(3):486-541.
[4] TangDL, KangR, BergheTV, et al. The molecular machinery of regulated cell death [J]. CellRes, 2019, 29(5):347-364.
[5] GalluzziL, BuquéA, KeppO, et al. Immunogenic cell death in cancer and infectious disease [J]. Nat Rev Immunol, 2017, 17(2):97-111.
[6] ATREYA C E, YAEGER R, CHU E. Systemic therapy for metastatic colorectal cancer: from current standards to future molecular targeted approaches[J]. Am Soc Clin Oncol Educ Book, 2017, 37: 246–256.
[7] HÉLÈNE B, MÉLANIE B, HÉLÈNE B, et al. Bleomycin exerts ambivalent antitumor immune effect by triggering both immunogenic cell death and proliferation of regulatory T cells[J]. PLoS One, 2013, 8(6): e65181..
[8] FESSLER E, MEDEMA J P. Colorectal cancer subtypes: developmental origin and microenvironmental regulation[J]. Trends Cancer, 2016, 2(9): 505–518.
[9] GARG A D, VANDENBERK L, KOKS C, et al. Dendritic cell vaccines based on immunogenic cell death elicit danger signals and T cell–driven rejection of high-grade glioma[J]. Sci Transl Med, 2016, 8(328): 328ra27.
[10] KUAI R, YUAN W, SON S, et al. Elimination ofestablished tumors with nanodisc-based combination chemoimmunotherapy[J]. Sci Adv, 2018, 4(4): eaao1736.
[11] ALIZADEH A M, KHANIKI M, AZIZIAN S, et al. Chemoprevention of azoxymethane-initiated colon cancer in rat by using a novel polymeric nanocarrier–curcumin[J]. Eur J Clin Pharmacol, 2012, 689(1–3): 226–232.
[12] GALLUZZI L, KEPP O, KROEMER G. Enlightening the impact of immunogenic cell death in photodynamic cancer therapy[J]. Embo J, 2014, 31(5): 1055–1057.
[13] CHOUAIB S, NOMAN M Z, KOSMATOPOULOS K, et al. Hypoxic stress: obstacles and opportunities for innovative immunotherapy of cancer[J]. Oncogene, 2017, 36(4): 439–445.
[14] CHEN Z, LIU L, LIANG R, et al. Bioinspired hybrid protein oxygen nanocarrier amplified photodynamic therapy for eliciting anti-tumor immunity and abscopal effect[J]. ACS Nano, 2018, 12(8): 8633–8645













